倫理審查資料遞交流程及注意事項
一、初始審查
總流程:在機構(gòu)受理審批簽字后(一)遞交電子版資料(無簽字蓋章版)→(二)形式審查并修改補充→(三)整理紙質(zhì)版資料并簽字蓋章遞交����,確定審查形式(此為倫理正式接收時間)→(四)資料掃描替換原“無簽字蓋章”版發(fā)倫理秘書存檔→(五)倫理費用支付→(六)主審委員預(yù)審→(七)郵寄15份精簡版資料→(八)遞交初始審查PPT(PI匯報)→(九)確定上會時間并召開會議→(十)領(lǐng)取批件。
具體說明:
(一)遞交電子版資料(無簽字蓋章版):
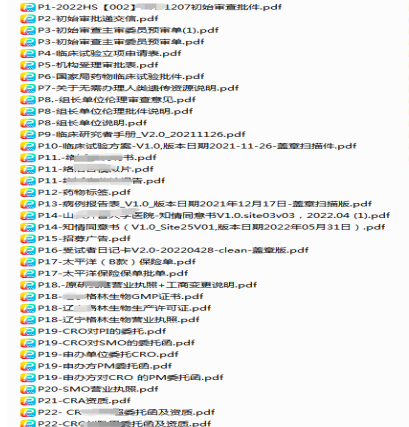
要求:參照“倫理文件夾目錄(清單)”(見附件1)整理��,根據(jù)頁碼(P)進行排序命名(示例如圖1)��,為避免來回簽字蓋章的麻煩����,此次遞交電子版資料可無簽字蓋章。
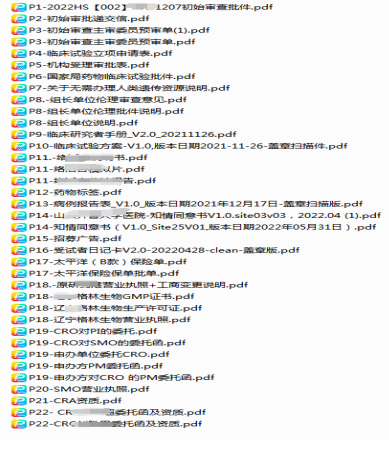
圖1
(二)形式審查并修改補充
要求:對于形式審查存在問題及需補充材料�,倫理委員會將以“初始形式審查意見表”(附件2)形式反饋CRA,CRA在“初始形式審查意見表”上回復(fù)。
(三)整理紙質(zhì)版資料并簽字蓋章遞交紙質(zhì)版文件資料
要求:根據(jù)以上整理好的電子版資料順序整理紙質(zhì)版資料并簽字蓋章����,倫理委員會只需一式一份,要求:
1 黑色文件夾���,厚度適中����;
2 制作好文件夾側(cè)面標簽,標簽內(nèi)容包含項目名稱�、NMPA等內(nèi)容,(示例如圖2):

圖2
3 紙質(zhì)版資料裝訂順序示例:

圖3
(四)資料掃描替換原“無簽字蓋章”版發(fā)倫理秘書存檔���。
將原來所有未簽字蓋章部分掃描替換成簽字蓋章版本(注意不要遺漏)�����,順序保持原電子版順序不變,原蓋章PDF版本無需替換�。
(五)倫理費用支付。
1)倫理審查收費標準
1. 會議審查倫理審查費為4800元/(次*項)(不含稅)�����;(目前稅費為1%)��。
2. 快速審查倫理審查費為1600元/(次*項)(不含稅)�;(目前稅費為1%)。
3. 會前3-5個工作日的緊急申請�,收取規(guī)定費用2倍的加急審查費;
4. 會前1-2個工作日內(nèi)的申請����,須經(jīng)主任委員簽字審批���,并收取規(guī)定費用5倍的加急審查;
5. 說明:如��,同一財務(wù)編號001的項目先后兩次遞交的申請算作兩次倫理審查����;不同財務(wù)編號001、002項目申請同一天會議審查算兩項����。
6. 打款需備注:項目財務(wù)編號-項目名稱簡介-用途(如:007-鹽酸XXXX片-初始倫理審查費;007-鹽酸XXXX片-偏離(2024.1.1-2024.3.31))
2)倫理審查費用相關(guān)事宜
1. 倫理審查費以匯款形式交至醫(yī)院財務(wù)部���,匯款請注明XXX(院內(nèi)財務(wù)編碼)項目XXX倫理審查費�;(具體備注請?zhí)崆奥?lián)系倫理秘書)
2. 醫(yī)院財務(wù)科倫理費接收賬號等信息如下:
名 稱:衡陽市中心醫(yī)院
賬 號:4388 9999 1010 0030 49567
開 戶 行:交通銀行衡陽分行營業(yè)部
統(tǒng)一社會信用代碼(稅號)1243 0040 4454 3051 3H
3. 醫(yī)院財務(wù)部開具正式發(fā)票���,申請者憑繳費憑證領(lǐng)取發(fā)票����。
4. 具體倫理審查費用參照醫(yī)院最新標準�。
(七)郵寄15份精簡版資料
精簡版資料包含:
1)臨床試驗倫理審查申請書 (初始審查)
2)國家局批件相關(guān)
3)試驗方案
4)知情同意書
5)研究者手冊
6)招募廣告
7)保險相關(guān)
以上資料精簡版資料裝訂并首頁形成目錄����,制定側(cè)標簽供翻閱�,共15份,圖示如下:請于會議當(dāng)天帶到會議室供委員會議現(xiàn)場翻閱���,會議結(jié)束后申辦方自行寄回�����。

(八)遞交初始審查PPT(PI匯報)
PI匯報PPT:
PPT統(tǒng)一用本中心模板�����,經(jīng)PI確認無誤后交倫理委員會秘書審核,匯報當(dāng)天申辦方代表或CRA到場����。PPT模板見附件3.
二、跟蹤審查
1 本中心年度跟蹤審查頻率一般為12個月(具體頻率見批件)���,請在距離初始審查12個月之前的一個月內(nèi)遞交年度定期跟蹤審查�����,初始審查日期以主委簽字時間為準��。
2 方案偏離/違背遞交頻率:經(jīng)研究者及申辦方判斷輕微方案偏離/違背每季度遞交一次����,經(jīng)研究者及申辦方判斷重大偏離/違背自發(fā)現(xiàn)之日起立即遞交。遞交頻率時間以初始審查批件日期為參照�����。
3 根據(jù)不同遞交類型SOP的需求���,除需遞交信外��,其他包含并不限于:
修正案需要遞交組長單位批件�����、修訂記錄(修正前后對比)�、修訂痕跡版�����、修訂后版本�;
本院SAE遞交中心+項目組版SAE首次�����、隨訪��、總結(jié)報告��;
偏離與違背需遞交“年度/定期跟蹤����、偏離登記表”���、方案偏離情況報告表及偏離情況詳細附表(偏離需注明遞交時間段���,要求每季度結(jié)束前遞交該季度偏離與違背);
年度/定期跟蹤審查需遞交“年度/定期跟蹤�、偏離登記表”、項目年度定期跟蹤審查研究進展報告�����;
結(jié)題審查需遞交臨床試驗結(jié)題小結(jié)表(機構(gòu)辦同意結(jié)題簽字蓋章)�����、結(jié)題審查申請表���;
����;
研發(fā)期間安全性更新報告需遞交組長單位批件��、研發(fā)期間安全性更新報告����、同意備案接收函或遞交信復(fù)印件,遞交頻率為每次安全性更新報告版本更新后����;
其他類型需遞交資料請根據(jù)實際情況或提前和倫理秘書聯(lián)系確定。
三�、衡陽市中心醫(yī)院臨床試驗倫理委員會聯(lián)系人:李德斌;電話:15211817561 �����;微信:lidebin396917203���。
